4月5日,国家市场监管总局发布口罩等防疫用品出口欧盟及美国市场认证信息指南,并公布《中国境内具有口罩等防疫用品CE认证能力的认证机构名录》,及《中国境内可以开展医疗器械管理体系(ISO13485)认证的机构名录》:
其中具有CE认证能力的认证机构有8家,可以开展医疗器械管理体系(ISO13485)认证的机构有44家,并附上各机构的联系方式。
Tips:关于出口企业关心的CE认证业务办理,比如认证时间、认证费用等具体问题,企业可详细咨询名单中的相关联系人。
为做好新冠肺炎疫情防控和经济社会发展工作,支持企业复工复产,针对企业不熟悉防疫物资出口政策等实际问题,现就口罩等防疫用品出口欧盟及美国的相关准入要求及梳理的国内具有相应资质能力的认证机构名录提供如下信息指南,供企业参考。
一、欧盟对口罩等防疫用品准入要求
(一)口罩
欧盟根据用途将口罩分为两类:医用口罩和个人防护口罩。
1.医用口罩
医用口罩需按照欧盟医疗器械指令93/42/EEC(MDD)或欧盟医疗器械条例EU2017/745(MDR)加贴CE标志,对应的标准是EN14683。根据口罩产品无菌或非无菌状态,采取的合格评定模式也不同。
(1)无菌医用口罩:必须由授权公告机构进行CE认证。
(2)非无菌医用口罩:企业只需进行CE自我符合性声明,不需要通过公告机构认证。在准备好相应文件及测试报告等资料后,即可自行完成符合性声明。
2.个人防护口罩
个人防护口罩不属于医疗器械,但需符合欧盟个人防护设备条例EU2016/425(PPE)要求,由授权公告机构进行CE认证并颁发证书,对应的标准是EN149。
(二)防护服
防护服也分为医用防护服和个人防护服,管理要求与口罩基本类似。医用防护服按照医疗器械管理,其中无菌医用防护服需按照欧盟医疗器械指令93/42/EEC(MDD)或欧盟医疗器械条例EU2017/745(MDR)获得CE认证,非无菌医用防护服只需进行CE自我声明。个人防护服需按照欧盟个人防护设备条例EU2016/425(PPE)获得CE认证。
(三)欧盟公告机构查询地址
1.欧盟医疗器械指令93/42/EEC(MDD)授权的公告机构查询地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=13
2.欧盟医疗器械条例EU2017/745(MDR)授权的公告机构查询地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
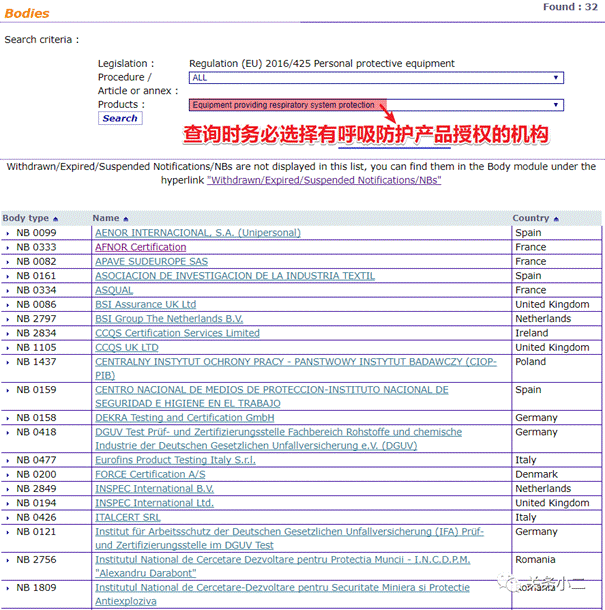
3.欧盟个人防护装备条例EU2016/425(PPE)授权的公告机构查询地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=155501
Tips:以口罩为例,在查询时务必下拉选择"Equipmentprovidingrespiratorysystemprotection",表示从名单中搜索具有呼吸器认证资质的认证机构。
二、美国对口罩等防疫用品准入要求
(一)口罩
美国对医用口罩和防护口罩同样区分管理,其中医用口罩由美国食品药品监督管理局(FDA)管理,而个人防护口罩则由美国国家职业安全卫生研究所(NIOSH)管理。
目前美国FDA已允许有条件将中国标准KN95口罩列入EUA紧急授权名单。
1.医用口罩
医用口罩需通过FDA注册,企业直接向FDA官网申请并提交相关材料。此外还有两种可选途径:
(1)已经获得NIOSH注册的N95口罩,在产品生物学测试、阻燃测试和血液穿透测试通过的情况下,可以豁免产品上市登记(510K),直接进行FDA工厂注册和医疗器械列名。
(2)如果获得持有510K的制造商的授权,可以作为其代工厂使用其510K批准号进行企业注册和器械列名。
2.个人防护口罩
防护口罩需通过NIOSH注册,企业直接在NIOSH官网申请。
(二)防护服
对医用防护服和个人防护服的管理也类似于口罩的管理方式,其中医用防护服由美国食品药品监督管理局(FDA)管理,而个人防护服由美国国家职业安全卫生研究所(NIOSH)管理。企业直接在FDA或NIOSH进行注册申请。
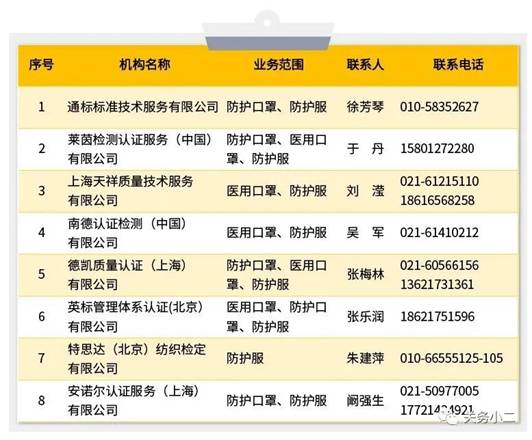
三、中国境内具有口罩等防疫用品CE认证能力的认证机构名录
(如不在此名单请联系市场监管局确认)
(如不在此名单请联系市场监管局确认)
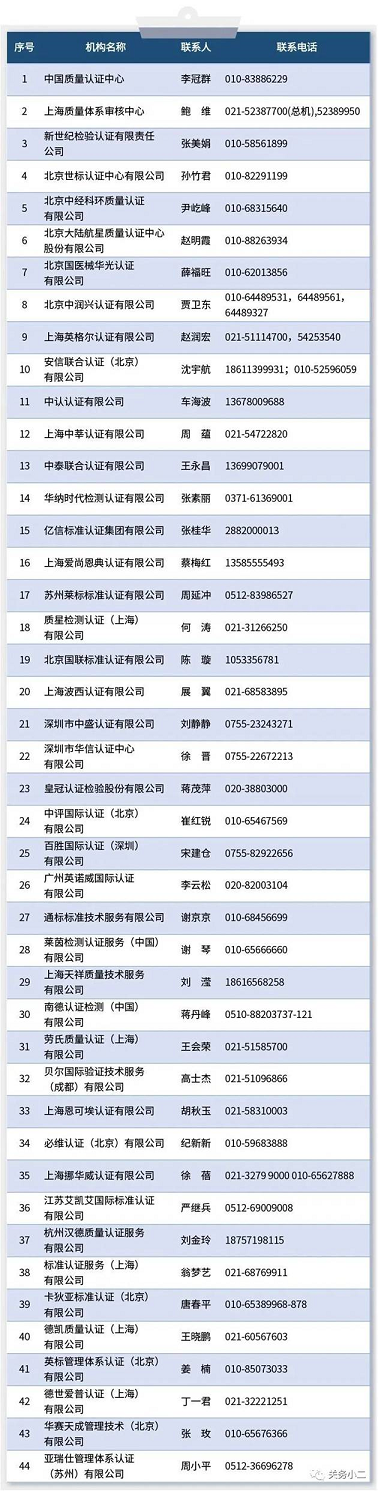
四、中国境内可以开展医疗器械管理体系(ISO13485)认证的机构名录
市场监管总局:虚假认证、买卖认证行为将被重点打击
4月5日,市场监管总局发布关于开展口罩、防护服等防疫用品领域认证活动专项整治行动的通知,决定自即日起,重点打击虚假认证、买证卖证等认证违法行为。
市场监管总局关于开展口罩、防护服等防疫用品领域认证活动专项整治行动的通知
各省、自治区、直辖市及新疆生产建设兵团市场监管局(厅、委):
新冠肺炎疫情发生以来,相关认证机构积极服务口罩、防护服等防疫用品生产企业,充分发挥质量认证市场经济“信用证”、国际贸易“通行证”作用,在帮助防疫用品顺利进入国际市场中发挥积极作用。
但也有个别机构肆意牟利、虚假认证甚至买证卖证,给企业造成经济损失,扰乱认证市场秩序,更影响口罩、防护服等防疫用品顺利出口。
为有力支持全球抗击疫情工作,规范认证市场秩序,现决定自即日起,市场监管部门开展口罩、防护服等防疫用品领域认证活动专项整治行动,重点打击虚假认证、买证卖证等认证违法行为。现将有关事项通知如下。
一、工作目标
围绕社会舆论突出反映的口罩、防护服等防疫用品虚假认证、买证卖证等问题,加大认证监管力度,严厉打击涉及防疫用品的认证违法行为,提升认证实施有效性,不断规范认证市场。
二、工作重点
(一)重点查处伪造、冒用、非法买卖认证证书和认证标志的违法行为。通过重点摸查辖区内口罩、防护服等防疫用品生产企业获得认证情况,及时发现相关认证违法违规行为线索。
(二)重点查处未经批准擅自在我国境内从事认证活动的违法行为。对发现的非法认证线索,及时进行核查处理并上报市场监管总局,由总局向社会发布警示信息。
(三)重点检查认证机构认证活动不规范的问题。针对经批准的认证机构,重点对其口罩、防护服等防疫用品领域认证活动进行检查,不断规范认证行为。
(四)重点检查认证价格违法问题。对发现的认证市场哄抬价格、串通涨价、价格欺诈等违法行为,严格按照《价格法》《价格违法行为行政处罚规定》依法依规严肃查处。
三、工作要求
(一)加强领导,迅速部署。各地市场监管部门要迅速行动,研究制定针对性强的监管措施,组织精干力量,全面加大认证执法力度。同时积极引导帮扶企业选择合法合规认证机构进行相关认证。
(二)拓宽渠道,主动作为。各地市场监管部门要畅通全国12315平台、12315专用电话,积极利用监督检查、受理投诉举报、舆情监测、企业摸查等多种渠道,深挖细查认证违法案件线索。
(三)从快办理,综合执法。对口罩、防护服等防疫用品相关的认证违法案件,要按照《市场监管总局关于依法从重从快严厉打击新型冠状病毒疫情防控期间违法行为的意见》(国市监法〔2020〕27号)优先加快办理,从重处罚。要关注认证行为、认证服务价格、认证宣传、产品质量等方面违法行为的关联性,加强综合执法。
(四)注重衔接,联动打击。要注重与公安、海关、药监等部门的衔接和协调,对涉嫌犯罪的及时移交公安部门,对涉嫌违法认证的出口产品信息及时通报海关部门,对医疗器械质量标准问题及时通报药监部门。
(五)主动发声,广泛宣传。各级市场监管部门要充分利用电视、广播、网络等传播渠道,广泛开展宣传,曝光典型案例,震慑认证违法违规行为。
各地市场监管部门要做好组织协调工作,指定专门的联络员,及时向上级部门报送信息。各省(区、市)市场监管部门应在2020年6月30日前将专项整治工作情况报市场监管总局认证监管司。

